新方法可以快速分析内在无序蛋白质的晶体结构
内在无序蛋白质 (IDP) 可以根据外部环境动态改变其构象,因此可以与不同的化合物结合。然而,它们很难分析。现在,东京理工大学的研究人员已经通过一种新颖的流程解决了这个问题,该流程可以通过无细胞蛋白质结晶技术快速分析 IDP 的晶体结构。
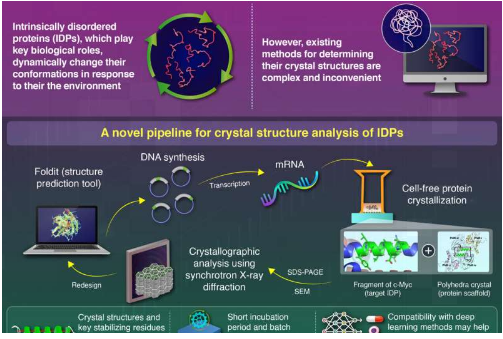
许多人更容易将蛋白质视为某种刚性的“分子机器”,每种蛋白质都具有明确的结构,可以实现或补充其功能。然而,许多重要的蛋白质缺乏这种固定的三维结构。相反,这些所谓的内在无序蛋白质 (IDP) 可以根据其外部环境采用各种不同的构象。IDP 的这种固有灵活性使它们用途广泛,并且通常能够与许多不同的化合物结合。
与其他类型的蛋白质相比,IDP 的分析难度很大。要了解 IDP 的生物学功能,有必要确定能够在原子水平上稳定其亚区的因素或决定因素。实现此目的的一种主要方法是将目标 IDP 与蛋白质晶体支架结合以固定目标 IDP,从而可以使用蛋白质晶体学技术。但是,目前可用的方法非常缓慢且不方便使用。
在此背景下,由日本东京工业大学生命科学与技术学院和国际研究前沿倡议 (IRFI) 的 Takafumi Ueno 教授领导的一支研究小组着手建立一种更可靠、更通用的方法。他们在《美国国家科学院院刊》上发表的最新研究中报告了一种用于快速分析 IDP 晶体结构的创新方法的开发。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
