纳米孔技术在单分子水平上展示伴侣蛋白的运输机制
蛋白质控制着人体的大部分功能,蛋白质的功能失调会导致严重后果,例如神经退行性疾病或癌症。因此,细胞有机制来控制蛋白质的质量。
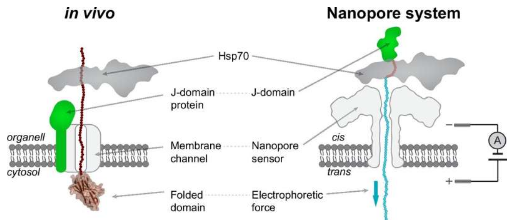
在动物和人类细胞中,Hsp70 类分子伴侣是这一控制系统的核心,负责监督一系列生物过程。然而,尽管 Hsp70 分子伴侣发挥着至关重要的作用,但其确切的分子机制几十年来仍未得到揭示。
日内瓦大学 (UNIGE) 的一个研究小组与 EPFL 合作,利用尖端的纳米孔单分子技术,在确定 Hsp70 分子伴侣如何产生操纵其客户蛋白结构所需的力方面取得了重大突破。这些结果结束了长达十年的争论,发表在《自然通讯》上。
蛋白质需要折叠成特定的三维形状才能正常发挥作用。在它们的多种作用中,像 Hsp70 这样的伴侣蛋白通常有助于蛋白质的正确折叠。为了成功完成这些任务,Hsp70 需要强行操纵蛋白质的结构,将它们从自发形成的聚集体中提取出来,或者通过促进蛋白质转位到关键的细胞区室(如线粒体)中。
在此背景下,在20世纪90年代和21世纪初,关于Hsp70分子伴侣驱动蛋白质易位的机制存在激烈的争论,人们根据不同的实验提出了两种主要模型,但并没有明确的答案。
2006 年,洛桑联邦理工学院的 Paolo De Los Rios 教授和洛桑大学 (UNIL) 的 Pierre Goloubinoff 教授及其合作者提出了一种名为“熵拉”的新理论。熵拉可以解释所有现有的蛋白质转运到线粒体的现象,也可以应用于 Hsp70 的其他细胞功能,例如蛋白质分解。
实验证据
多年来,该理论已经可以解释越来越多的结果,但仍然没有得到直接的实验证实。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
