产生用于治疗 tau 病的 tau 去磷酸化靶向嵌合体
病理性 tau 蛋白的积累在阿尔茨海默病 (AD) 和许多其他 tau 病的神经变性中发挥着关键作用。因此,改善大脑中病理性tau蛋白聚集是药物开发的重要方向。然而,由于 tau 本身在维持细胞结构和功能方面发挥着多方面的生理作用,因此针对 tau 蛋白一般形式的传统策略可能有些武断。
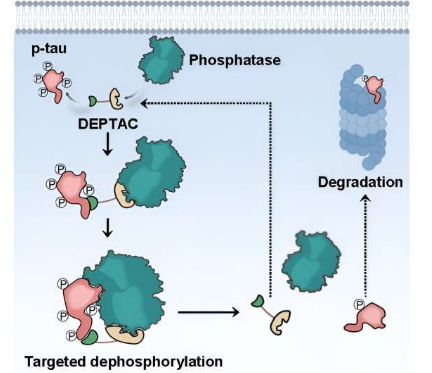
由于 tau 蛋白的病理性过度磷酸化会引发 tau 蛋白病中神经原纤维缠结和神经变性的形成,因此特异性下调 tau 蛋白磷酸化可能更适合治疗这些疾病。然而,直接使用 tau激酶抑制剂或磷酸酶激活剂会产生不可接受的毒副作用,因为这些酶中的每一种都会同时调节除 tau 之外的许多信号通路。
该研究发表在《科学通报》上,由王建志教授(华中科技大学同济医学院病理生理学教研室)和郑杰教授(华中科技大学基础医学院神经生物学教研室)领导。北京大学)和王晓川教授(华中科技大学同济医学院病理生理学教研室)。
为了实现tau蛋白的特异性去磷酸化,王建志和她的团队提出了一种策略——去磷酸化靶向嵌合体(DEPTAC),它能够特异性劫持tau蛋白的磷酸酶以削弱其过度磷酸化。 DEPTAC由以下基序组成:(1)特异性识别和结合tau的“弹头”,(2)用于募集磷酸酶的“锚”,(3)基序间连接子,(4)细胞膜穿透序列,如果需要的话。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
